



跨越星河万里,不倦久伴朝夕。
七夕,不仅饱含着对浪漫爱情的憧憬,更承载了人们对“人长久,共婵娟”的美好生活的愿望。
人类世界每一次科技或是文化上的向上突破,都在努力让世间的美好来日方长。
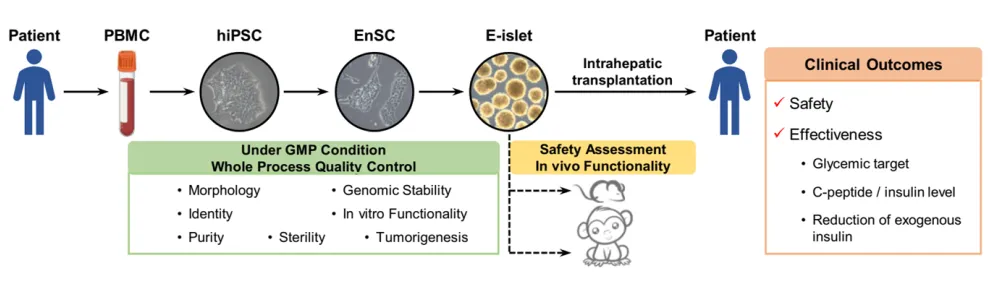
前几天,我们在【泉果101】系列视频发布了中国在糖尿病治疗领域的世界级突破——中国医疗专家披露了世界首例“通过再生胰岛完全治愈2型糖尿病”的研究成果。上海长征医院殷浩和中科院程新两位教授的科研团队强强联手,经过十余年研究,利用患者血液PBMC重编程为自体iPSC细胞,并使用国际首创技术使之转变为“种子细胞”,最终实现在体外再造胰岛组织(E-islet)。
视频播出之后,很多朋友辗转传达消息,希望能够了解到这种新型糖尿病治愈方案的细节,什么时候能广泛应用?成本大概如何?
应大家要求,我们特别找到了殷浩和程新两位教授在国际学术期刊《细胞发现》(Cell Discovery) 发表的论文,并提炼了梗概。在后续,我们也会为大家持续关注这一项目的最新进展。
图1. 中国科学院分子细胞科学卓越创新中心程新研究组,联合海军军医大学上海长征医院殷浩团队发布的最新研究成果

我们也把这份科研报告作为七夕的健康礼物,愿您人生健康相随、花期无限——“人长久、共婵娟”!

论文精编:

Treating a type 2 diabetic patient with impaired pancreatic islet function by personalized endoderm stem cell-derived islet tissue

2型糖尿病(T2D)患者,通常是因为胰岛素抵抗和胰岛素缺乏两种原因导致患病。
*胰岛素抵抗:身体对胰岛素调节的敏感度减弱甚至失效,不能有效利用胰岛素。
*胰岛素缺乏:胰岛中分泌胰岛素的β细胞数量减少或功能退化,无法分泌足够的胰岛素。
因此,大约30%的2型糖尿病患者,需要终身依赖注射胰岛素,来控制血糖水平。
*1型糖尿病(T1D)则是一种自体免疫性疾病,患者的胰岛细胞受到自体的淋巴细胞攻击,导致胰岛素分泌减少或缺失。
如果血糖长期管理不佳,会造成视网膜病变(严重会失明)、糖尿病肾病(肾衰竭)、心脑血管疾病、周围神经性病变(如糖尿病足)等一系列并发症。
胰岛移植——从逝者捐献的胰腺中,分离出胰岛细胞,然后移植到患者的体内,成为了脆性1型及2型糖尿病的有效治疗方法;同时,胰岛移植有利于糖尿病肾病(肾衰竭)肾移植后患者的血糖控制,进而对移植肾的长期存活和功能维持具有积极意义。
(值得一提的是,殷浩教授团队主持完成的胰岛移植手术例数也位居全国第一。)
然而,由于供体器官严重短缺,且要从胰腺中成功分离出胰岛细胞的难度非常高,以及患者胰岛移植后的免疫排斥反应等,限制了胰岛移植在临床上的大规模应用。
因此,在体外再造胰岛组织,用于替代供体胰岛,对彻底治愈糖尿病具有重大的应用价值。
如何再造胰岛组织?近年来,干细胞疗法提供了解题思路,并取得了进展。
既往研究证明,利用人多能干细胞(hPSCs)可以生成胰腺前体细胞(pancreatic progenitor cells)和胰岛组织(islets tissues),并且已经通过了动物实验。
此外,最近的一项临床试验表明,人多能干细胞(hPSCs)在体外定向分化的胰腺前体细胞,经非免疫隔绝的生物相容性包囊包裹后,经过皮下移植,可以在1型糖尿病(T1D)患者体内进一步成熟,分化为餐后反应性β样细胞,并响应饮食刺激分泌胰岛素。尽管其分泌的量可能不足以使患者完全摆脱对外源性胰岛素的依赖。换句话说,虽然这些细胞有助于改善血糖控制,但患者可能仍然需要额外的胰岛素注射来维持正常的血糖水平。
同时,最大的问题在于,人多能干细胞(hPSCs)制备胰岛细胞的分化过程非常复杂,目标细胞的纯度难以保证,而且可能存在一些未完全分化的细胞残留在体内,有形成畸胎瘤(teratomas)的风险。
为了克服这些挑战,亟需寻找一种既能高效产生胰岛细胞,又具有特异性分化潜能、不具有体内成瘤性的干细胞类型。
这就是殷浩和程新教授带领的研究团队做的事情:
程新教授团队在世界上首次建立了系胚层特异性干细胞系——内胚层干细胞(EP cells)及其改良类型EnSC(Endoderm stem cell);EnSC在内胚层(胰腺、肝脏等)定向分化特异性及体内安全性方面具有优势,是体外规模化再造胰岛组织的优选种子。
他们通过创新性地利用患者血液PBMC,重编程为自体iPSC细胞;
并使用国际首创技术使之转变为“种子细胞”,即内胚层干细胞EnSC;
然后经过两个关键中间步骤,制备了在形态、内分泌细胞组成及比例、纯度、基因表达、体内外功能等方面与成体胰岛相近的再生胰岛组织E-islets。
并利用有免疫缺陷的小鼠模型、有糖尿病的小鼠和猴子模型、以及人源化小鼠模型,分别评估了胰岛组织E-islet的体内存活、成瘤风险、体内功能及免疫原性,验证了E-islet的安全性和有效性。
图2. 患者E-islet制备、质量控制及其移植安全性和有效性评估的主要流程概述
2021年7月19日,用于经皮门静脉介入输注移植治疗因终末期糖尿病肾病而接受过肾脏移植的、胰岛功能受损的一例2型糖尿病(T2D)患者。成为世界首例利用干细胞来源的自体再生胰岛组织移植治愈胰岛损伤性T2D的探索性临床研究。
案例介绍:
患者是一名59岁男性,有25年的2型糖尿病(T2D)史,发展为终末期糖尿病肾病(糖尿病的严重并发症之一),于2017年6月,接受了肾移植手术。自2019年11月以来,血糖控制情况非常差,表现为:血糖波动幅度大,血糖在目标范围内的时间只有56.7%,且多发高血糖及低血糖……血糖控制不好,对移植后的肾脏长期存活严重不利,因此患者同意进行自体内胚层干细胞衍生的胰岛组织E-islets的移植。
2021年7月19日,在临床前研究的基础上,临床团队成功将120万胰岛当量的E-islets以经皮肝门静脉介入输注方式移植到患者肝脏内,定期观察安全性及有效性。
术后观测期内,该患者:
■ 血糖控制显著改善
移植后第2周,患者的平均血糖波动(MAGE)显著下降。血糖在目标范围内的时间(TITR)比例从术前的56.7%,第32周开始,恢复到99%以上。
■ 严重血糖波动事件显著减少
通过24小时实时连续血糖监测系统(CGM)的监测,患者术后两周内,严重的血糖波动事件完全消失,因此也减少了血糖波动引起的并发症风险。
■ 胰岛素和降糖药的需求减少与停用
患者在第11周实现完全停用胰岛素;第44周起,研究人员开始逐步减少患者口服降糖药物的用量,并在第48周和第56周完全停用。
■ HbA1c和空腹C-肽水平显著改善
患者的HbA1c水平(糖化血红蛋白,是一种反映过去2到3个月平均血糖水平的血液检测指标,是糖尿病长期管理的关键指标)从基线时的6.6%下降至第113周的4.6%,血糖控制持续改善;
平均空腹C-肽水平也较手术前增加了3倍,表明患者体内胰岛素的生物合成和分泌功能得到了逐渐恢复。
■ 餐后血糖反应明显改善
通过混合餐耐量测试(MMTT),证实患者的餐后血糖反应得到了显著改善,餐后血糖浓度的最大值从基线的21.3mM降低至第105周的9.1mM。
总结来说,术后27个月的数据显示,患者的血糖控制显著改善;且通过相关的实验表明,患者胰岛移植后耐受良好,且没有肿瘤指征或其他相关的严重不良事件。
研究团队并没有停下脚步,还在进行样本量的扩大,对完全失去胰岛β细胞的1型糖尿病(T1D)患者进行研究。截至目前,研究团队已成功开展并治愈了多例脆性1型糖尿病患者,这也有助于明确E-islets在达成血糖控制目标中的确切机制。
最后,研究者提示未来的研究方向将聚焦:1)干细胞来源的再生胰岛组织作为临床药物的药效学等研究;2)适应症的进一步拓展以及;3)开发无需免疫抑制的“通用型”再生胰岛组织的制备技术。
参考资料:
Wu J, Li T, Guo M, et al. Treating a type 2 diabetic patient with impaired pancreatic islet function by personalized endoderm stem cell-derived islet tissue[J]. Cell Discov. 2024 Apr 30;10(1):45. doi: 10.1038/s41421-024-00662-3. PMID: 38684699; PMCID: PMC11058776
2024-08-12 11: 26
2024-08-12 11: 25
2024-08-12 11: 24
2024-08-12 11: 23
2024-08-12 11: 23
2024-08-12 11: 22