据多家外媒报道,美国食品和药物管理局(Food and Drug Administration)已于10月22日批准吉利德科学公司(Gilead Sciences)的抗病毒药物瑞德西韦Veklury(remdesivir)用于治疗新冠患者,这是美国首个正式获批的新冠治疗药物。吉利德科学公司表示,此药可以将新冠肺炎住院患者的住院时间缩短5天。
受利好消息刺激,截至发稿,在美股盘前,吉利德科学涨超7.5%。
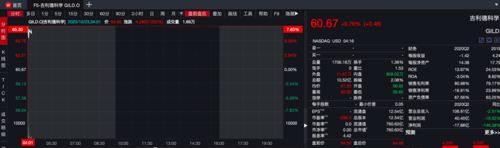
瑞德西韦获批为美国首款新冠治疗药 吉利德盘前涨超7.5%
10月23日,美国食品和药物管理局(FDA)公告称抗病毒药物瑞德西韦正式获批上市,适用于12岁及以上且体重至少40千克(约88磅)的需要住院的COVID-19成年和儿童患者。
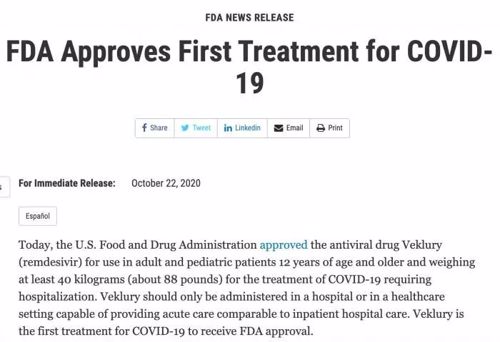
来源:美国食品和药物管理局
FDA是在特朗普与民主党总统候选人拜登举行最后一场辩论的几个小时前宣布这项决定。本月初,在美国总统特朗普感染新冠肺炎后,瑞德西韦也是其治疗药物之一。
据报道,这一批准是基于三项随机对照临床试验的结果,其中包括最近公布的美国国家过敏和传染病研究所(NIAID)赞助的3期临床试验ACTT-1。该试验显示,与安慰剂相比,Veklury治疗住院COVID-19患者时,在多项结局评估中产生了具有临床意义的改善。例如,与安慰剂相比,Veklury将患者恢复所需时间降低了5天(10天 vs. 15天)。这项研究已于近日在《新英格兰医学杂志》上发表。基于这些数据,Veklury已经成为治疗住院COVID-19患者的标准治疗。
今年5月,FDA曾为瑞德西韦发放了治疗新冠肺炎的紧急使用授权,允许医生在未得到FDA正式批准的情况下,对住院患者使用该药物。业内人士认为,正式获批意味着瑞德西韦今后在临床使用的阻碍将减小。
FDA批准Veklury的同时,还发布了一项新的紧急使用许可(EUA),允许使用Veklury治疗12岁以下的住院儿科COVID-19患者(体重至少为3.5kg),这些患者在临床上适合使用静脉注射(IV)药物。本授权是临时性的,并且不能替代在该患者人群中使用Veklury的正式提交、审查和批准过程。
预计5天疗程费用2340美元
据外媒报道,大多数接受瑞德西韦治疗的患者将接受5天的疗程,使用6瓶药物。对于美国政府医保项目和其他医保体系覆盖的患者,5天疗程的费用为2340美元,对于在美国私人医保投保的患者,费用为3120美元。
今年8月,该公司表示,计划在今年年底前生产200多万个瑞德西韦疗程,预计到2021年能再生产“几百万个疗程”,并补充说,自今年1月以来,该药物的供应增加了50多倍,制造网络现覆盖北美、欧洲和亚洲的40多家公司。
本周四(10月22日),吉利德公司表示,正在满足美国对该药物的实时需求,并预计本月将满足全球需求,即使未来新冠确诊病例可能激增。
公司还表示,瑞德西韦在另外约50个国家或地区拥有监管批准或临时授权。此外,如果批准,该公司还将开发一种可吸入药物,可在医院外使用。
据FDA介绍,使用瑞德西韦可能出现的副作用包括肝酶水平升高和过敏反应,比如血压和心率变化、低血氧、发烧、呼吸急促、气喘、嘴唇或眼周红肿、皮疹、恶心、出汗或发抖。

世卫组织:瑞德西韦几乎无效
然而,瑞德西韦的疗效却饱受争议。
就在本月15日,世界卫生组织公布了瑞德西韦、羟氯喹等药物的临床试验结果,称这些药物对于降低新冠肺炎致死率“几乎无效”(little or no effect)。
在过去7个月里,世卫组织在30个国家对11266名新冠患者进行了对比试验,随机选择一定数量的患者分别使用瑞德西韦、羟氯喹、洛匹那韦、干扰素、干扰素加洛匹那韦治疗,剩余患者则不使用试验药物作为对照。受试患者中,使用瑞德西韦的患者数量最多,达2750名。
但最终研究结果显示,从总体死亡率、接受呼吸机治疗时间及住院时间这些方面进行对比,这些试验用的药物全都“对新冠治疗收效甚微,或是根本没有效果”。
从“全球的希望”到“跌落神坛”?
从“全球的希望”到“跌落神坛”再重新爬起,瑞德西韦经历数个月的“煎熬”。
1月31日瑞德西韦通过《新英格兰医学杂志》(NEJM)进入大众视野。
4月29日《柳叶刀》在线正式发表瑞德西韦第一项临床试验的数据结果。
4月10日,针对瑞德西韦在全球的进展,Daniel O’Day发布了一封公开信,称目前瑞德西韦有七项临床试验已经启动,预计在4月底获得瑞德西韦针对重症患者研究的初步数据,但在中国“因入组停滞,针对重症患者的研究已停止”。成为瑞德西韦的一大转折点。
4月29日,《柳叶刀》正式发表了瑞德西韦第一项临床试验的数据结果,即在中国湖北十家医院开展的,针对重症新冠肺炎患者的随机、双盲、安慰剂对照的多中心试验。结果显示,与安慰剂相比,接受瑞德西韦给药治疗并没有显著提高新冠肺炎患者的临床改善时间、死亡率或病毒清除时间。换句话说,瑞德西韦的疗效不明显。
同日,吉利德和美国国立卫生研究院(NIH)则发布公告称其临床试验显示瑞德西韦显示出积极的效果,且已达到其主要终点。接受瑞德西韦治疗的晚期患者康复速度快于接受安慰剂的患者。
5月1日,瑞德西韦迎来了监管的突破,FDA授予瑞德西韦治疗重症新冠肺炎患者的紧急使用许可(EUA),“尽管在瑞德西韦治疗新冠肺炎的使用中,关于人的安全性和有效性的信息知之甚少,但该试验药物已在一项临床试验中显示,可缩短某些患者的康复时间”。
5月5日,在瑞德西韦获得FDA紧急使用授权后,吉利德发表了扩大其供应的声明。
瑞德西韦目前已在欧盟获得有条件上市许可。5月12日,吉利德宣布已与5家仿制药生产商达成授权协议,允许他们在127个国家/地区生产销售抗病毒药瑞德西韦(remdesivir),不包括美国。这5家公司分别为Mylan、Cipla、Ferozsons Laboratories、Hetero Labs与Jubilant Lifesciences。
部分综合观察者网、21世纪经济报道等





