人民金融·创新药数据库监测显示,4月28日,百济神州的帕米帕利胶囊的第一轮补充资料已完成,如进展顺利,有望在二季度获批上市;近期,药明巨诺的CAR-T疗法产品瑞基仑赛注射液、泽璟制药的抗肿瘤新药甲苯磺酸多纳非尼片、海正药业的海泽麦布片通过了生产现场检查,这些创新药品种距离获批上市又前进了一步。
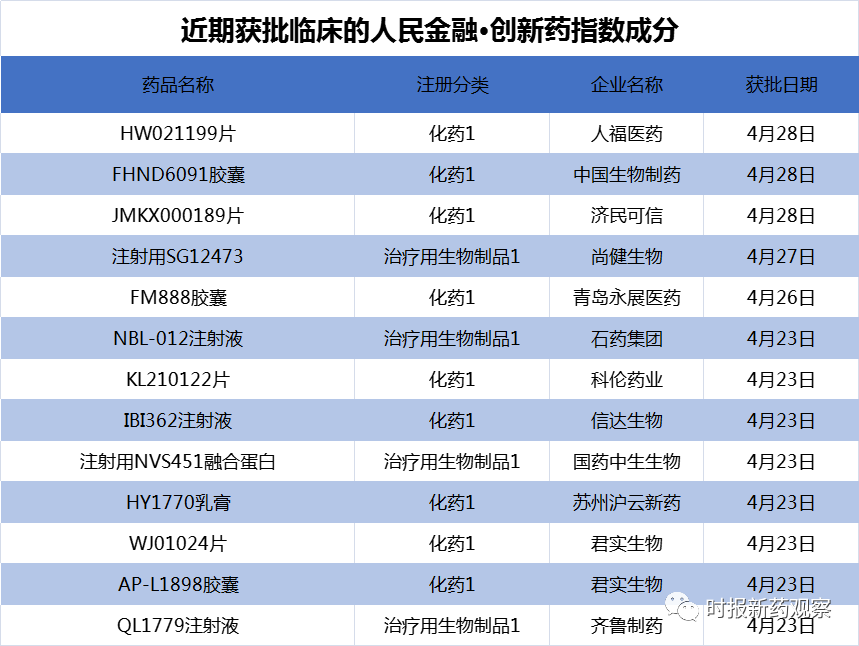
另外,在4月23日至4月29日的发布周期内,华领医药的首创新药多扎格列艾汀上市申请获受理,有望成全球首个获批上市的葡萄糖激酶激活剂类糖尿病治疗药物;人福医药、中国生物制药、济民可信等的13个创新药首次获批临床,我们将这些品种纳入了“人民金融·创新药指数”。
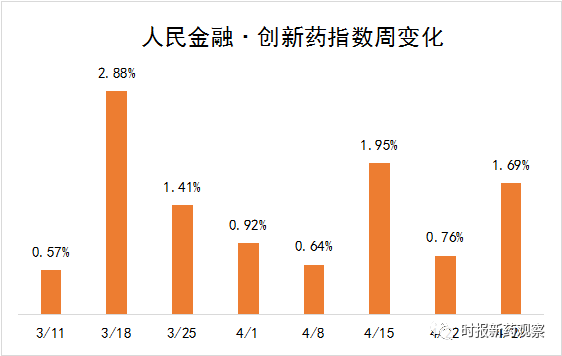
受这些因素影响,近期我国创新药研发呈强劲增长势头,新发布周期内,“人民金融·创新药指数”涨1.69%,最新报1593.88点。
百济神州第三款创新药即将获批
4月28日,百济神州的PARP抑制剂帕米帕利胶囊的第一轮补充资料已完成,如后续没有发补信息,大概率将进入行政审批阶段,进展顺利的话,有望在二季度获批上市,成为百济神州第三款获批的自主研发新药。去年7月,帕米帕利用于治疗卵巢癌的新药上市申请获国家药监局受理,并同期被纳入优先审评程序。
PARP是抗癌药靶点之一,PARP抑制剂通过阻断癌细胞中的DNA损伤修复,从而导致毒性累积,最终使同源重组修复缺陷的癌细胞死亡。中泰证券认为,PARP抑制剂有望成为极具潜力的广谱抗肿瘤药。我国每年新发卵巢癌、乳腺癌、胰腺癌、前列腺癌患者分别约为5.21万、27.24万、9.01万、6.03万例,仅考虑BRCA突变患者,市场规模在30亿元。考虑胃癌、肺癌、食管癌等其他适应症和无BRCA突变的同源重组突变患者,市场规模有望超过250亿元。
在PARP抑制剂赛道,我国已有奥拉帕利、尼拉帕利、氟唑帕利3款上市。其中,恒瑞医药的氟唑帕利去年12月获批,是首个国产PARP抑制剂药物。中信建投预计氟唑帕利将成为重磅品种,预计国内销售峰值达到50亿元。
百济神州的帕米帕利有望成为第二款国产PARP抑制剂药物,目前帕米帕利作为单一疗法或与其他药物联用的全球临床开发正在不断推进中,研究覆盖卵巢癌、前列腺癌、乳腺癌、胃癌、胶质母细胞瘤等多个治疗领域。
新发布周期内,药明巨诺的CAR-T疗法产品瑞基仑赛注射液、泽璟制药的抗肿瘤新药甲苯磺酸多纳非尼片、海正药业的海泽麦布片通过了生产现场检查,这些创新药品种距离获批上市又前进了一步。
在我国CAR-T细胞治疗领域,药明巨诺的瑞基仑赛注射液和复星凯特的阿基仑赛注射液研发进展最快,均处于上市申请阶段。复星凯特阿基仑赛注射液的上市申请今年初曾被报送国家药监局,进入行政审批阶段,不过随后又退回到了药审中心进行技术审评,目前处于补充资料阶段。这两个CAR-T疗法产品有望在2021年获批上市,开启中国CAR-T疗法的商业化元年。
近期,华领医药的首创新药多扎格列艾汀上市申请获受理。这是华领医药自创立以来的首个新药上市申请,多扎格列艾汀将成为全球范围内首个提交新药上市申请的葡萄糖激酶激活剂类糖尿病治疗药物,并有望成为在中国首先上市的全球首创新药。
去年8月,华领医药与拜耳就多扎格列艾汀在中国达成商业合作协议,根据协议条款,华领医药将获得3亿元人民币的预付款,此外其还将获得额外最高可达41.8亿元人民币的里程碑付款。与国际医药巨头拜耳的合作,无疑是行业对于多扎格列艾汀市场前景的肯定。
基石药业普拉替尼新适应症纳入优先审评
近期新获批上市的创新药中,基石药业首个商业化产品普拉替尼再传喜讯。
4月26日,基石药业宣布,普拉替尼拓展的针对甲状腺癌的新适应症获国家药监局受理并被纳入优先审评。
据了解,甲状腺癌是最常见的内分泌恶性肿瘤,近几年发病率显著上升。中国甲状腺癌每年的新发病例约有9万例,死亡病例约有6800例。大约10-20%的甲状腺乳头状癌(最常见的甲状腺癌)患者携带RET融合,大约50-90%的晚期MTC(约占甲状腺癌的2-5%)患者携带RET突变。但在国内,RET变异的甲状腺癌尚无精准靶向药物,患者只能接受多靶点非选择性药物的治疗,疗效有限且安全性差。
研究数据显示,在RET突变的甲状腺髓样癌和RET融合阳性的甲状腺癌患者中,普拉替尼表现出优异且持久的疗效以及良好的耐受性。
普拉替尼是中国首个获批的选择性RET抑制剂,由基石药业合作伙伴Blueprint Medicines公司开发。今年3月,国家药监局批准普拉替尼以商品名普吉华®上市销售,用于既往接受过含铂化疗的RET基因融合阳性的局部晚期或转移性非小细胞肺癌成人患者的治疗。普吉华®新适应症获批后,将惠及更多中国患者。
据了解,未来,基石药业将推进普拉替尼在中国的研发,更广泛地评估其在包括一线NSCLC、甲状腺癌和其它实体瘤患者中的疗效。
13个创新药获批临床
在4月23日至4月29日的发布周期内,来自人福医药、中国生物制药、济民可信等的13个创新药获批临床,我们将其纳入了“人民金融·创新药指数”。新纳入13个创新药后,“人民金融·创新药指数”的成分样本升至840个。
新发布周期内,君实生物有两款创新药获批临床,分别是EGFR非常见突变抑制剂AP-L1898胶囊(项目代号“JS111”)和XPO1抑制剂WJ01024片(项目代号“JS110”)。
根据君实生物的公告,JS110特异性阻断XPO1蛋白功能,抑制包括p53在内多种抑癌蛋白出核,加强抑癌蛋白功能,由于其独特的作用机制,JS110的开发有望给晚期肿瘤病人带来全新的治疗手段。JS111的开发有望给携带EGFR exon 20插入突变等EGFR非常见突变的肿瘤患者带来新的治疗方式。现有的EGFR-TKI、化疗和免疫疗法对于携带EGFR exon 20 插入等EGFR非常见突变的非小细胞肺癌患者临床获益有限,患者具有迫切的临床治疗需求。
尚健生物此次获批临床的SG12473为PD-L1/CD47双抗。国内CD47靶点竞争较为激烈,当前已有10余款CD47单抗获批临床,翰思生物、信达生物、盛禾生物等的PD-1/CD47双抗也进入了临床阶段。目前,尚健生物共有4款创新药进入了临床阶段,除SG12473外,还有PD-1单抗SG 001、CD38单抗SG3847、SIRPα融合蛋白SG404。
4月23日,石药集团附属公司上海新石生物的NBL-012获国家药监局默认许可临床试验,拟用于治疗银屑病、化脓性汗腺炎、炎症性肠病等慢性炎症疾病,及其它自身免疫性疾病。石药集团称,NBL-012 是首个针对IL-23p19 的全人源IgG4抗体,具有低免疫原性和低副作用的潜在优势。今年1月,NBL-012的新药临床试验申请已获美国FDA批准。
另外,新发布周期内,康方生物、恒瑞医药等的创新药临床试验状态向前推进。
4月28日,康方生物宣布,其全球首创PD-1/CTLA-4双抗Cadonilimab(研发代号:AK104)获批开展一线治疗晚期宫颈癌全球III期临床,这是中国首个一线宫颈癌双免疫疗法的III期临床研究。药物临床试验登记与信息公示平台显示,恒瑞医药近期登记启动了SHR-1701或安慰剂联合BP102和XELOX一线治疗晚期结直肠癌的II/III期临床研究,SHR-1701为首个进入临床阶段的国产PD-L1/TGFβ双特异性抗体。
2021-04-30 00: 59
2021-04-30 00: 56
2021-04-30 00: 00
2021-04-30 00: 00
2021-04-29 22: 08
2021-04-29 21: 44